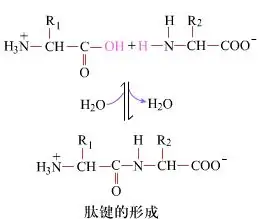
Na površini je tvorba peptidnih vezi, ki tvorijo dipeptide, preprost kemični proces.To pomeni, da sta dve aminokislinski komponenti povezani s peptidno vezjo, amidno vezjo, medtem ko sta dehidrirani.
Tvorba peptidne vezi je aktivacija aminokisline v blagih reakcijskih pogojih.(A) karboksilni del, druga aminokislina (B) Nukleofilno aktiviran karboksilni del nato tvori dipeptid (AB)."Če karboksilna komponenta (A) ni zaščitena, tvorbe peptidne vezi ni mogoče nadzorovati."Stranski produkti, kot so linearni in ciklični peptidi, se lahko zmešajo s ciljnimi spojinami AB.Zato morajo biti vse funkcionalne skupine, ki niso vključene v tvorbo peptidne vezi, zaščitene na začasno reverzibilen način med sintezo peptidov.
Torej sinteza peptidov - tvorba vsake peptidne vezi - vključuje tri korake združevanja.
Prvi korak je priprava nekaterih aminokislin, ki potrebujejo zaščito, zwitterionska struktura aminokislin pa ne obstaja več.
Drugi korak je dvostopenjska reakcija za tvorbo peptidnih vezi, pri kateri se karboksilna skupina N-zaščitene aminokisline najprej aktivira v aktivni intermediat in nato nastane peptidna vez.Ta sklopljena reakcija se lahko pojavi kot reakcija v enem koraku ali kot dve zaporedni reakciji.
Tretji korak je selektivno odstranjevanje ali popolno odstranjevanje zaščitne podlage.Čeprav lahko do celotne odstranitve pride šele po sestavitvi vseh peptidnih verig, je za nadaljevanje sinteze peptidov potrebna tudi selektivna odstranitev zaščitnih skupin.
Ker 10 aminokislin (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec in Cys) vsebuje funkcionalne skupine stranske verige, ki zahtevajo selektivno zaščito, zaradi česar je sinteza peptidov bolj zapletena.Zaradi različnih zahtev po selektivnosti je treba ločiti začasne in poltrajne zaščitne podlage.Začasne zaščitne skupine se uporabijo v naslednjem koraku, da odražajo začasno zaščito aminokislinskih ali karboksilnih funkcionalnih skupin.Poltrajne zaščitne skupine se odstranijo brez poseganja v že oblikovane peptidne vezi ali stranske verige aminokislin, včasih med sintezo.
"V idealnem primeru bi morala biti aktivacija karboksilne komponente in kasnejša tvorba peptidnih vezi (reakcije spajanja) hitra, brez nastajanja racemnih ali stranskih produktov, za doseganje visokih izkoristkov pa je treba uporabiti molarne reaktante."Na žalost nobena od metod kemijskega spajanja ne izpolnjuje teh zahtev in malo jih je primernih za praktično sintezo.
Med sintezo peptidov so funkcionalne skupine, vključene v različne reakcije, običajno povezane z manualnim centrom, glicin je edina izjema, in obstaja potencialno tveganje za rotacijo.
Zadnji korak v ciklu sinteze peptidov je odstranitev vseh zaščitnih skupin.Selektivna odstranitev zaščitnih skupin je pomembna za podaljšanje peptidne verige poleg zahteve po popolni odstranitvi zaščite pri sintezi dipeptida.Sintetične strategije je treba skrbno načrtovati.Odvisno od strateške izbire lahko N selektivno odstrani α-amino ali karboksilne zaščitne skupine.Izraz »strategija« se nanaša na zaporedje kondenzacijskih reakcij posameznih aminokislin.Na splošno obstaja razlika med postopno sintezo in kondenzacijo fragmentov.Sinteza peptidov (znana tudi kot "konvencionalna sinteza") poteka v raztopini.V večini primerov je mogoče postopno podaljševanje peptidne verige sintetizirati le z uporabo peptidne verige za sintezo krajših fragmentov.Za sintetiziranje daljših peptidov je treba ciljne molekule segmentirati v ustrezne fragmente in ugotoviti, da lahko zmanjšajo stopnjo diferenciacije na koncu C.Ko bodo posamezni fragmenti postopoma sestavljeni, bo ciljna spojina združena.Strategija sinteze peptidov vključuje izbiro najboljšega in najprimernejšega zaščitnega fragmenta, strategija sinteze peptidov pa izbor najprimernejše kombinacije zaščitnih baz in najboljše metode konjugacije fragmentov.
Čas objave: 19. julij 2023